On entend souvent dire que les taux de décroissance radioactive qui sert à la datation radiométrique, carbone 14 ou autres, pourraient avoir varié dans le temps. Voyons cela.
Mise en jambe
Le noyau d’un atome est uniquement déterminé par le nombre de protons et de neutrons qu’il contient. Autour du noyau tournent un nombre d’électrons égale au nombre de protons du noyau. Pour des raisons de mécanique quantique, ces électrons sont disposés en couches, un peu comme un oignon (ou Shrek).

Représentation (très) schématique d’un atome. Il peut y avoir plus de 3 couches, et plus d’un électron par couche. Le nombre électrons est égale au nombre de protons dans le noyau. Lors d’une désintégration, la particule éjectée tombe sur les électrons de la couche interne.
Certains noyaux, comme notre bon vieux carbone-12 (6 protons, 6 neutrons) sont stables. Mettez-en mille milliards dans une boite. Allez faire un tour puis jetez un œil : il y en a toujours mille milliards.
D’autres, comme le célèbre carbone 14 (6 protons, mais 8 neutrons) sont instables. Mettez-en mille milliards dans une boite. Allez faire un tour puis jetez un œil : il y n’y en plus mille milliards. Certains se sont changés en azote-14 (7 protons, 7 neutrons). Si votre promenade a duré 5 730 ans environ, vous trouverez que la moitié de vos noyaux de C14 se sont changés en azote. Cette durée, 5 730 ans, est la demi-vie du C14.
La radioactivité est donc un phénomène complètement naturel (faut pas le dire à Greenpeace), qui change un noyau en un autre. Sur les quelques 3 000 noyaux connus, environ 250 seulement sont stables. Tous les autres sont radioactifs.
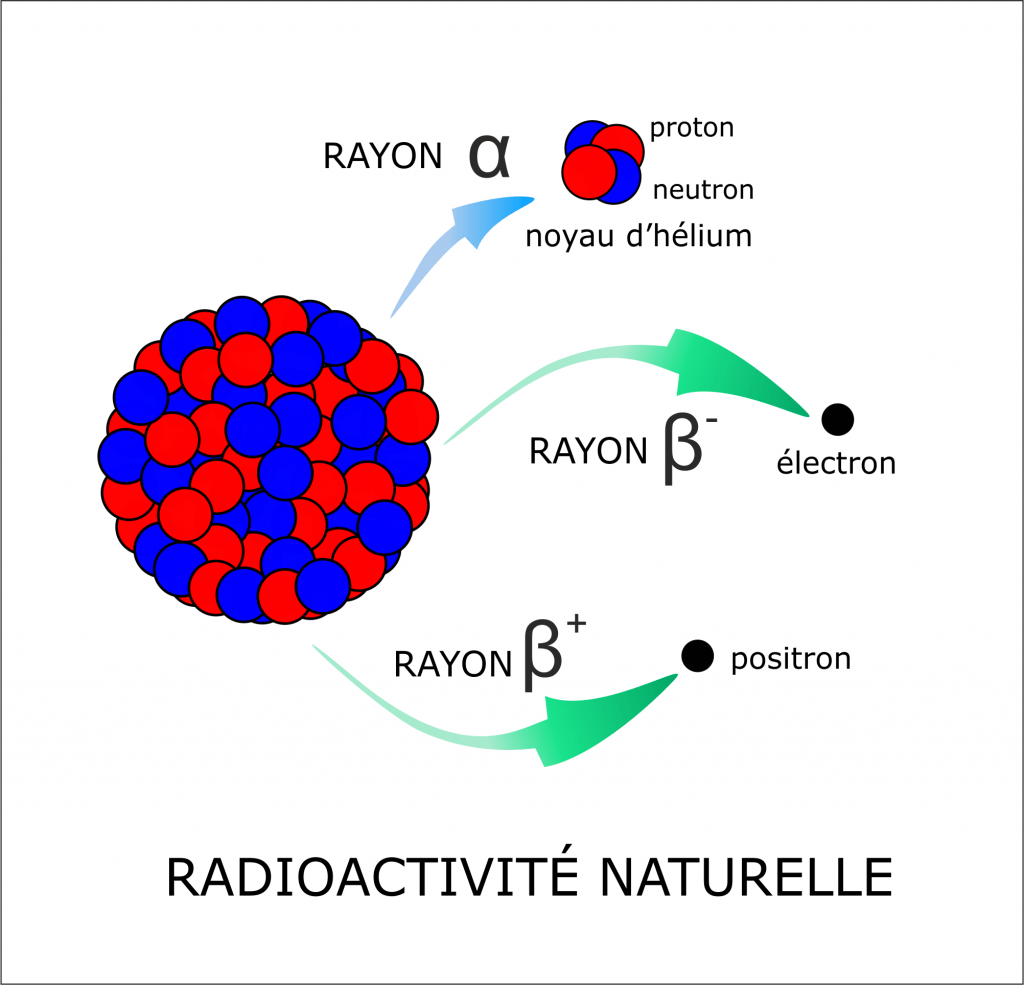
Lorsqu’un noyau radioactif se change en un autre, il éjecte quelque chose. Les principaux cas de figures sont :
- Le noyau éjecte deux neutrons et deux protons à la fois. On parle alors de radioactivité « alpha ».
- Le noyau éjecte un électron. On parle alors de radioactivité « beta moins ».
- Le noyau éjecte un positron (antiparticule de l’électron). C’est la radioactivité « beta plus ».
Le taux de décroissance radioactif détermine la vitesse à laquelle se produit le processus. La demi-vie d’un atome radioactif est le temps qu’il faut pour que la moitié de mon échantillon se soit transmuté. Elle est le fruit des lois de la physique. Il y a donc 2 possibilités pour qu’elle change :
- Soit les lois elle-même changent.
- Soit, dans les limites de ces lois, certains phénomènes la font changer.
Les lois de la physique nucléaire ont-elles changé ?
Je ferai ici appel à cet article sur la vitesse de la lumière. Comme on l’y explique, aucune observation ne permet actuellement de dire que les lois de la nature que nous connaissons, physique nucléaire y compris, ont changé dans le passé. Mentionnons en particulier les observations de désintégration radioactives distantes de millions d’année lumières, où l’on observe les mêmes taux qu’ici et maintenant (c’est dans l’article).
Rappelons en outre que changer les lois de la nature, c’est perdre l’argument de l’ajustement fin, ainsi que la conservation de l’énergie (c’est aussi dans l’article).
Rien, donc, ne permet de dire que les lois de la physique nucléaires ont changé dans les derniers milliards d’années. Passons donc à la seconde possibilité.
Les taux peuvent-ils changer… sans que changent les lois ?
Oui. Voyons cela.
La radioactivité est un phénomène purement quantique. La demi-vie dépend de la probabilité qu’a la particule éjectée de sortir du noyau. Au sortir du noyau, cette particule va tomber sur les électrons de la couche interne de l’atome. Les plus proches du noyau.
On peut donc imaginer que si l’on enlève ces électrons internes, en ionisant complétement l’atome par exemple (c’est-à-dire en lui ôtant tous ses électrons), la particule éjectée du noyau tombe sur un environnement modifié, ce qui pourrait altérer la probabilité qu’elle avait de sortir. Un peu comme il est plus facile, ou difficile, de sortir d’une pièce selon que la pièce voisine est bondée ou pas. Et en effet, cela peut se passer.
Le record en la matière appartient au Rhenium-187 (75 protons, 112 neutrons). Radioactif beta-moins, il éjecte un électron et se transforme en Osmium-187. Sa demi-vie est de 42 milliards d’années. En 1987, des théoriciens s’amusèrent à calculer la demie vie du même atome, épluché de ses 75 électrons. Ils trouvèrent… 14 ans !! L’expérience, très difficile à réaliser, fut faite en 1996 et on mesura 33 ans. Un accord théorie/expérience excellent, compte tenu de la variation de la demi-vie en jeu (dizaines de milliards d’années -> dizaine d’années) et des défis que présentent ce genre d’expériences.
Pour les curieux, ce changement spectaculaire s’explique, en partie seulement, par le fait que l’électron éjecté lors de la désintégration beta-moins sort plus facilement du noyau s’il ne rencontre pas d’autres électrons à la sortie (les électrons se repoussent). Le reste est affaire de mécanique quantique. Un bon point de départ pour en savoir plus est le paragraphe Wikipedia sur le sujet (ou bien le chapitre 5 de mon livre).
Comment donc peut-on faire confiance à la datation radioactive (carbone 14 et autre) ?
Si donc les lois de la nature autorisent de fortes variations des demi-vies, comment peut-on les considérer constantes pour la datation ?
Simplement parce que les conditions requises pour changer les demi-vies sont extrêmes. On pourrait de prime abord penser « ôter tous les électrons, c’est pas très compliqué ». En fait, ça l’est. Pour ôter son unique électron à l’hydrogène, par exemple, il faut une température d’environ 10 000 degrés. Pour faire la même chose avec les 6 électrons du carbone, environ 400 000 degrés. Quant au Rhenium-187, il faudra le chauffer à plus de 65 millions de degrés pour lui ôter ses 75 électrons et diviser sa demi-vie par environ 1 milliard. Et ce sont des limites basses.
On pourrait faire le parallèle avec la datation d’un arbre via le décompte de ses anneaux. Les arbres peuvent brûler, ce qui détruirait leurs anneaux, non ? Mais si j’en ai un sous la main, c’est justement qu’il n’a pas brûlé.
Si donc l’os que je veux dater au carbone 14 est entre mes mains, c’est qu’il n’a jamais été chauffé à plus de 400 000 degrés. Les électrons des couches internes se sont donc tenus tranquilles, et je n’ai pas de soucis à me faire pour la demi-vie.
Conclusion
Terminons par la supposée détection expérimentale de variations du taux de décroissance radioactive de certains atomes, avec la distance terre-soleil. Deux commentaires à ce sujet :
- La déviation en question est de 0,1%. Cette déviation se reporterait sur la datation, ajoutant donc une incertitude 0,1% au résultat final. Quand on sait que la datation C14 (ainsi que les autres) souffre en général d’une imprécision de l’ordre de 10%, on voit qu’une déviation de 0,1% ne changera pas grand-chose. C’est un peu comme si vous appreniez que la longueur d’un pont pourrait avoir variée d’un centimètre, tandis que vous ne pouvez de toute façon le mesurer qu’à 1 mètre près. Vous acquiesceriez poliment, tout en songeant que vous vous soucierez de ce genre de détail le jour où vous aurez une précision du centimètre.
. - Quand des gens font une mesure étonnante et importante, comme cette histoire de demi-vies qui varient, d’autres vont tenter de la reproduire. Si 1 équipe, puis 2, puis 3 retrouvent indépendamment les unes des autres le même résultat, la chose est claire : il se passe quelque chose. Mais si d’autres équipes ne retrouvent pas les résultats, il y a un problème.
Dans le cas présent, ceux qui ont tenté de répéter les mesures n’ont détecté aucune variation des taux. Il suffit pour s’en convaincre de voir les articles qui ont cité le travail initial.
Ainsi donc, les lois de la nature qui elles, n’ont pas changé, autorisent des variations des demi-vies. Mais dans des conditions si extrêmes que, tel l’arbre dont je ne pourrais compter les anneaux s’il avait brûlé, si l’objet que je veux dater y avait été soumis, il ne serait qu’un tas de cendres.
On peut ainsi compter sur la constance temporelle des demi-vies pour la datation radiométrique et notamment au carbone 14.